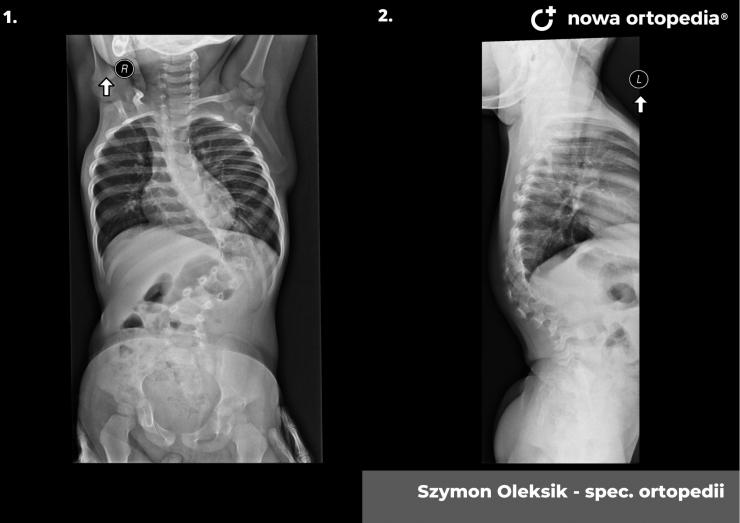
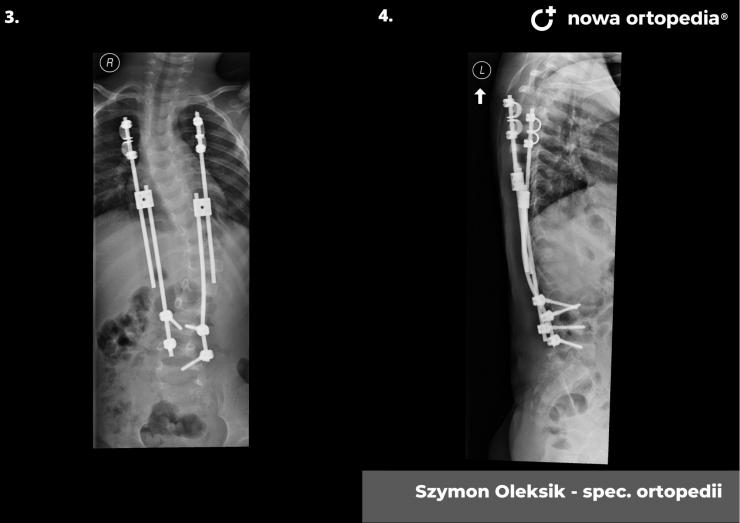
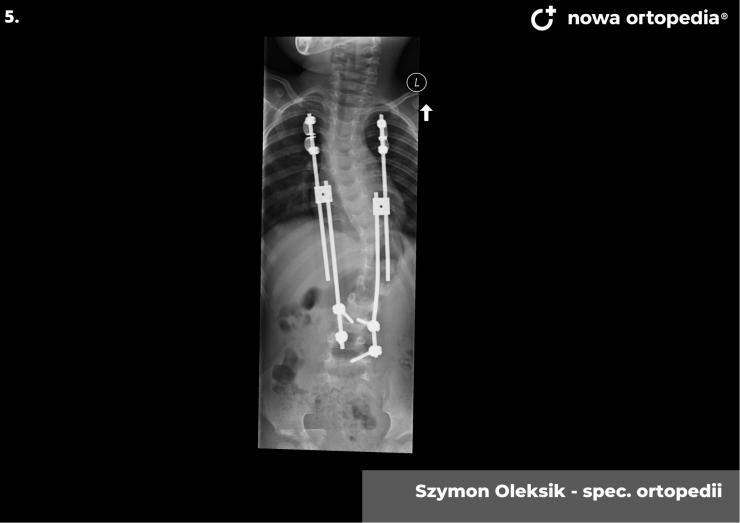
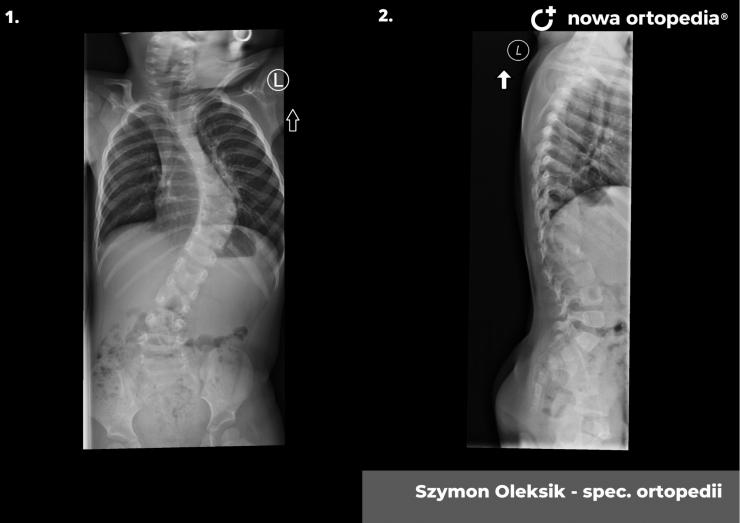
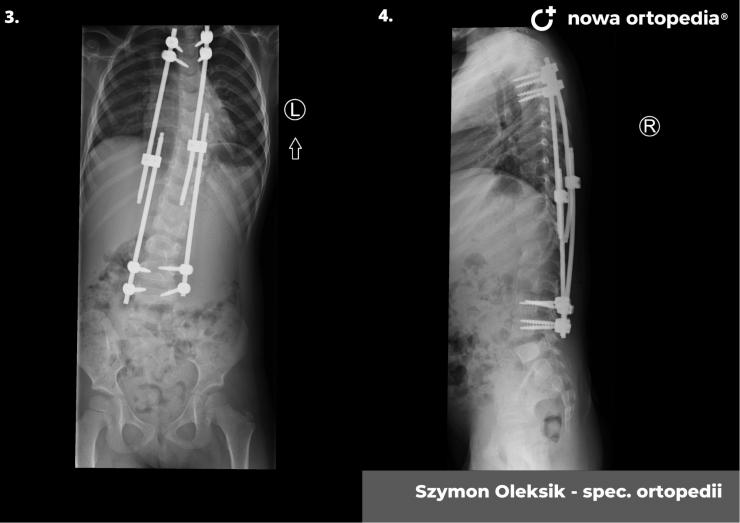
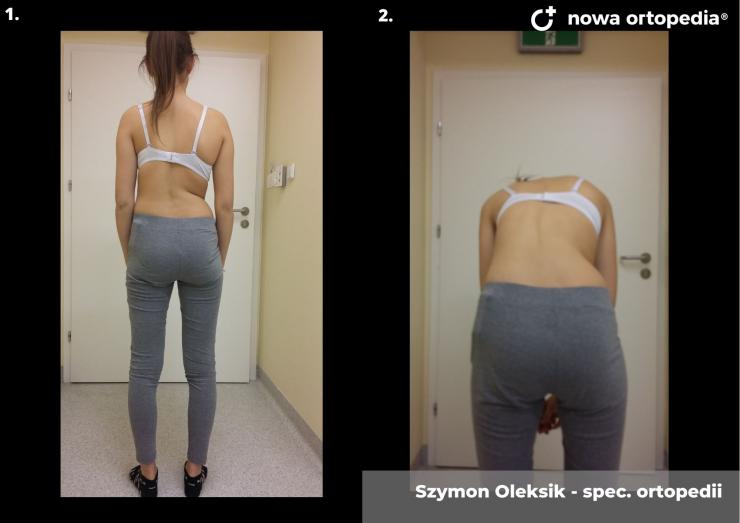
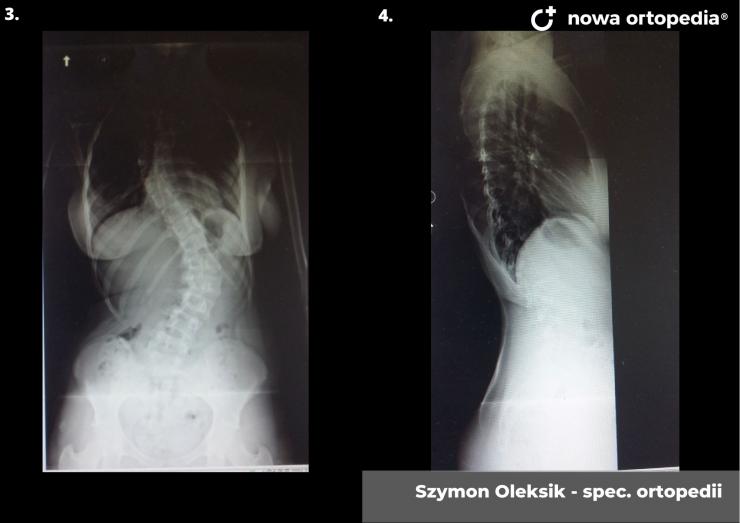
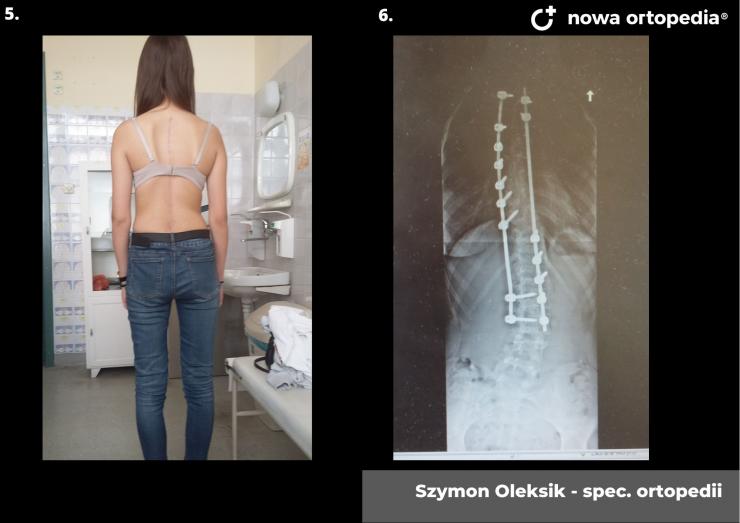
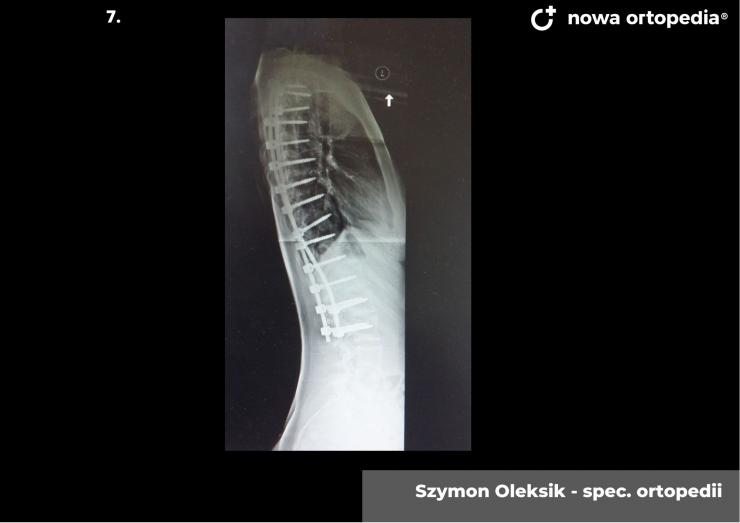
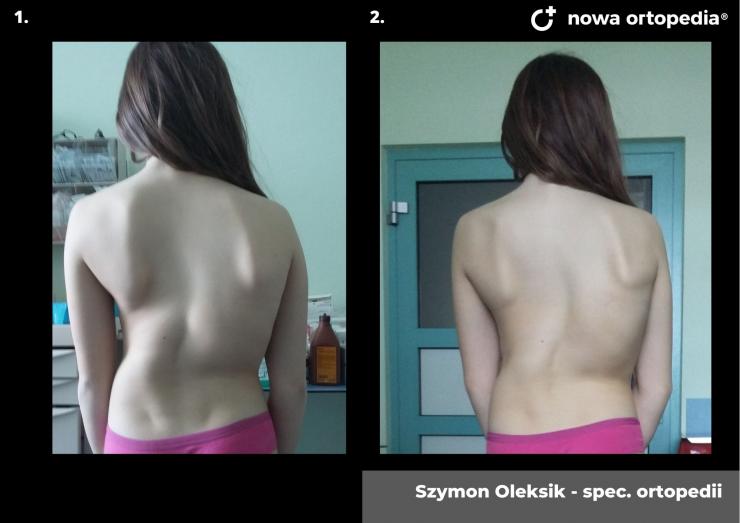
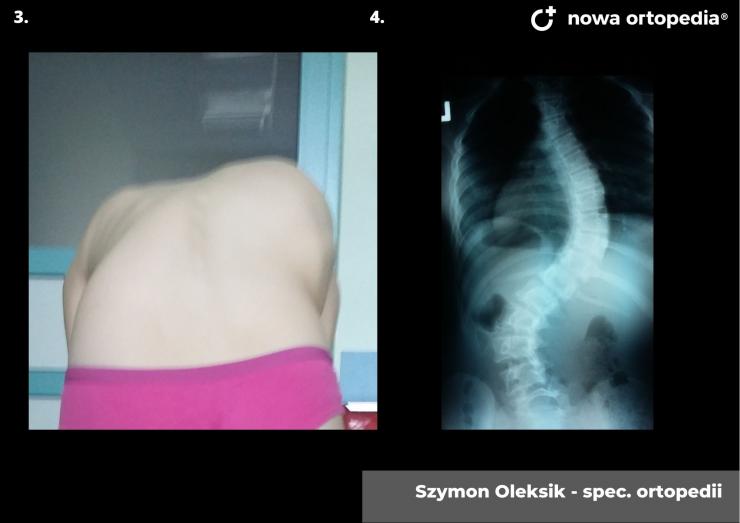
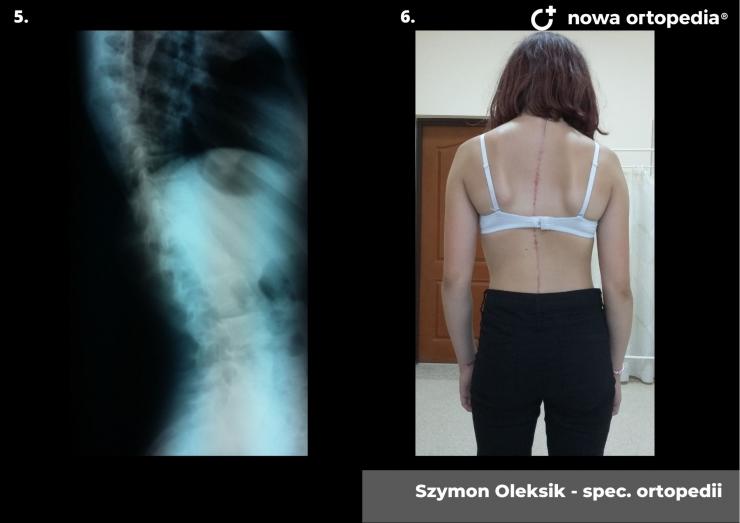
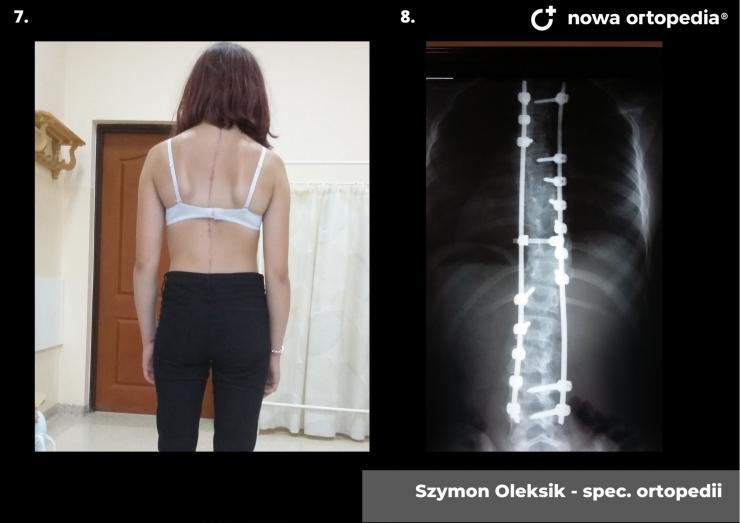
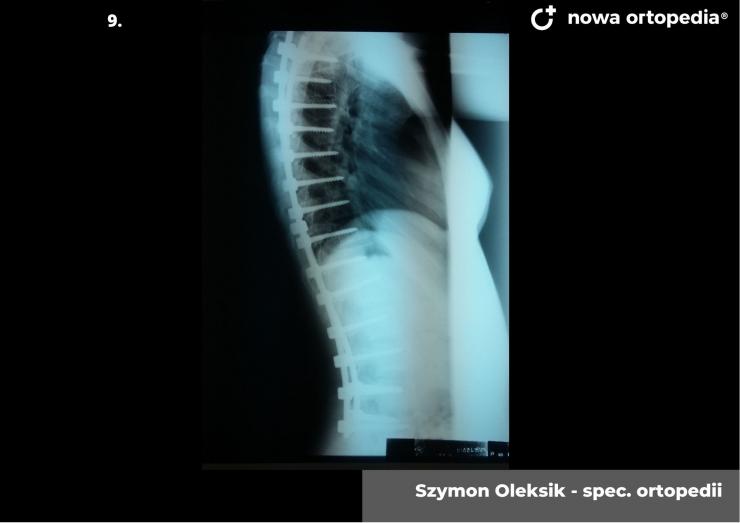
Toczeń rumieniowaty układowy (TRU) jest to choroba autoimmunologiczna. Pomimo licznych badań w czasie ostatnich lat, pochodzenie choroby pozostaje nieznane. Pierwsze wzmianki na temat dolegliwości na twarzy przypominających „ugryzienie wilka” pochodzą z XIII wieku, a historia związana z TRU jest długa i zawiła. Na początku traktowana była wyłącznie jako choroba dermatologiczna. W 1895 roku Cazenave wraz ze swoimi współpracownikami sklasyfikowali ją jako lupus erythemateaux, czyli jako chorobę dotyczącą skóry. Jednak w tym samym czasie pojawiły się pierwsze zmianki o tym, że TRU być może należy postrzegać jako chorobę systemową, wieloukładową, ponieważ towarzyszą jej inne objawy, takie jak gorączka, anemia itp. Na początku XX wieku zaczęto również zwracać uwagę na zmiany w nerkach, jako te, które często mogą przyczyniać się do śmierci chorego na TRU. Ostatecznie stwierdzono, że choroba może być związana z prawie każdym narządem. Charakteryzuje się naprzemiennymi okresami remisji oraz nawrotami. Pojawia się najczęściej u kobiet w wieku reprodukcyjnym, ale może wystąpić w każdym okresie od pierwszego do dziewięćdziesiątego roku życia. Istotne jest rozróżnienie między aktywnymi fazami tocznia spowodowanymi mechanizmami zapalnymi oraz zakrzepowymi, a przewlekłymi okresami choroby. Schorzenie związana jest z udziałem różnego typu autoprzeciwciał, które pomagają we wskazaniu rozpoznania. Monitorowanie jej przebiegu przeprowadza się często z wykorzystaniem skali aktywności choroby tzw. BILAG, czyli oceny obecności przeciwciał skierowanych przeciw dsDNA oraz stężenia składowych C3 i C4 dopełniacza.
Umów wizytę teraz - do lekarza specjalizującego się w leczeniu tocznia rumieniowatego w naszym szpitalu
Czy toczeń jest dziedziczny?
Przypuszcza się, że za wystąpienie choroby odpowiedzialnych jest kilka czynników. Predyspozycja genetyczna jest jednym z nich, ale nie wystarczającym. Jest to szczególnie zauważalne w przypadku bliźniąt. Wykazano, że ryzyko tocznia u bliźniąt jednojajowych wynosi 25 proc., natomiast u dwujajowych wynosi od 2-5 proc. Toczeń może się też pojawić u osób u których w rodzinnie nie było przypadków zachorowalności. Sprzyjającymi warunkami rozwojowymi toczenia są czynniki hormonalne, środowiskowe oraz immunologiczne.
Przyczyny toczenia rumieniowatego układowego
- promieniowanie UV (u niektórych osób światło słoneczne może wywołać zmiany w obszarze skóry lub reakcję wewnętrzną);
- przebyte infekcje ( w toku niektórych zakażeń może rozwijać się toczeń. Przykładem są wirusy cytomegalii, Epsteina-Barr lub HCV);
- zaburzenia gospodarki hormonalnej (przede wszystkim u kobiet);
- zażywanie niektórych leków ( antybiotyki, leki na układ krwionośny);
- stres;
- dieta wysokotłuszczowa;
- palenie tytoniu;
- niektóre toksyny;
- brak wysiłku fizycznego .
Objawy toczenia rumieniowatego układowego
Najczęstszym objawem towarzyszącym chorym jest męczliwość. Oprócz tego charakterystycznymi objawami są gorączka, limfadenopatia oraz utrata masy ciała. Diagnostyka różnicowa tych objawów jest obszerna i obejmuje zarówno procesy zapalne, jak i nowotworowe. Występujące objawy można podzielić na:
- Objawy mięśniowo-szkieletowe związane z bólami stawów oraz z poranną sztywnością lub obrzękiem stawów. U większości pacjentów nie występuje deformacja stawów, ale u niektórych dochodzi do rozwoju artropatii Jaccouda, która jest odwracalną artropatią związaną z wiotkością torebki stawowej.
- Objawy skórne związane z pojawieniem się rumienia w kształcie motyla. U chorych może wystąpić zmiana skórna, powstała na skutek nadwrażliwości na światło i może się utrzymywać przez kilka tygodni nawet po krótkiej ekspozycji na słońce. Do innych charakterystycznych objawów skórnych należy objaw Raynaud, który wynika z odruchowych skurczów naczyń obwodowych kończyn, livedo reticularis posiadające siatkowaty układ zmian, które częściej pojawiają się u pacjentów z zespołem antyfosfolipidowym (APS), które spowodowane jest stanem zapalnym tkanki podskórnej przyczyniające się do rozwoju bolesnych guzków skóry oraz łysienie, które może być zarówno rozsiane oraz plackowate.
- Objawy ze strony układu oddechowego związane z pojawieniem się bólu w klatce piersiowej przy wdechu, najczęściej przy zapaleniu opłucnej. Może wynikać z aktywności choroby, zatorowości płucnej lub wtórnym zakażeniem i wtedy wymagane jest uważne badanie w celu wyjaśnienia przyczyny. Do mniej spotykanych objawów objawów ze strony układu oddechowego zalicza się zapalenie płuc, krwotok płucny oraz nadciśnienie płucne.
- Objawy ze strony układu krążenia związane najczęściej z zapaleniem osierdzia. Rzadziej może wystąpić zapalenie mięśnia sercowego mogące objawiać się arytmią oraz niewydolnością serca. Innym mniej spotykanymi powikłaniami jest rozwój atypowych jałowych rozrostów na zastawkach serca tzw. zapalenie wsierdzia Libmana-Sacksa. Może ono przyczynić się do niewydolności serca, dysfunkcji zastawek, epizodów zatorowych a także infekcyjnym zapaleniem wsierdzia.
- Objawy ze strony układu pokarmowego związane z owrzodzeniem jamy ustnej, bólem brzucha, nudnościami, wymiotami lub biegunką. Najcięższym powikłaniem żołądkowo-jelitowym jest zapalenie naczyń jelita, ze względu na ryzyko progresji do niedokrwienia oraz perforacji. Do innych objawów brzusznych zalicza się aseptyczne zapalenie otrzewnej, podostra niedrożność jelit, zapalenie wątroby, stwardniające zapalenie dróg żółciowych, enteropatia z utratą białka, zapalenie trzustki i wodobrzusze.
- Choroby nerek związane ze zmianami w nerkach.
- Objawy ze strony układu nerwowego. Toczeń może powodować zaburzenia lękowe, bóle głowy, problemy z widzeniem, napady drgawek oraz zaburzenia psychiczne.
- Objawy ze strony układu rozrodczego u kobiet w wieku reprodukcyjnym. Pacjentki mogą zgłaszać nawrotowe poronienia, szczególnie w fazie choroby. Jest prawdopodobieństwo podwyższonego ryzyka martwych urodzeń lub przedwczesnego porodu albo urodzenia dziecka z wewnątrzmacicznym zahamowaniem wzrostu.
Przebieg leczenia
Jedną z ważniejszych oznak mogących wskazywać na rozpoznanie tocznia jest leukopenia w badaniu krwi pełnej. Mogą również występować niedokrwistość oraz małopłytkowość. Inną istotną cechą jest różnica między nieproporcjonalnie podwyższonym OB., a niskim lub prawidłowym CRP. U pacjentów z przeciwciałami antyfosfolipidowymi można zauważyć wydłużenie czasu aktywowanej protrombiny (APTT), który nie podlega normalizacji po zmieszaniu z osoczem prawidłowym, czego można spodziewać się w sytuacji niedoborów składników kaskady krzepnięcia. Stężenia składników C3 i C4 dopełniacza mogą mieć niski poziom ze względu na zmniejszone wytwarzanie oraz większe zapotrzebowanie szczególnie w czasie aktywności choroby.
W leczeniu tocznia przydatne są :
- niesteroidowe leki przeciwzapalne (NLPZ), do których należy łagodzenie bólu oraz sztywność stawów;
- kremy, maści oraz olejki chroniące przed promieniowaniem UV;
- kortykosteroidy leki stosowane w leczeniu TRU, podaje się je doustnie oraz dożylnie;
- immunosupresyjne leki stosowane u pacjentów, u których leczenie kortykosteroidami nie przyniosło poprawy, lub w celu zmniejszenia dawki steroidów.
- leki wpływające na gospodarkę lipidową.
Bibliografia :
1. https://podyplomie.pl
2. https://www.medistore.com.pl
3. Daca A., Bryl E. Toczeń rumieniowaty układowy — kryteria diagnostyczne i kliniczne skale oceny aktywności choroby — rys historyczny. Forum Medycyny Rodzinnej 2013, tom 7, nr 5, 225–243.